2025年4月27日,依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告),创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行审查,拟同意以下申请项目进入特别审查程序,现予以公示。公示时间为2025年4月27日至5月14日。公示中共有9款医疗器械,其中有3款IVD领域产品,分别是: 广州市金圻睿生物科技有限责任公司的“结核分枝杆菌复合群耐药基因突变检测试剂盒(可逆末端终止测序法)”;清谱科技(苏州)有限公司的“2-羟基戊二酸/谷氨酸检测试剂盒(原位电离质谱法)”;杭州德适生物科技有限公司的“染色体核型辅助诊断软件”,具体内容如下: 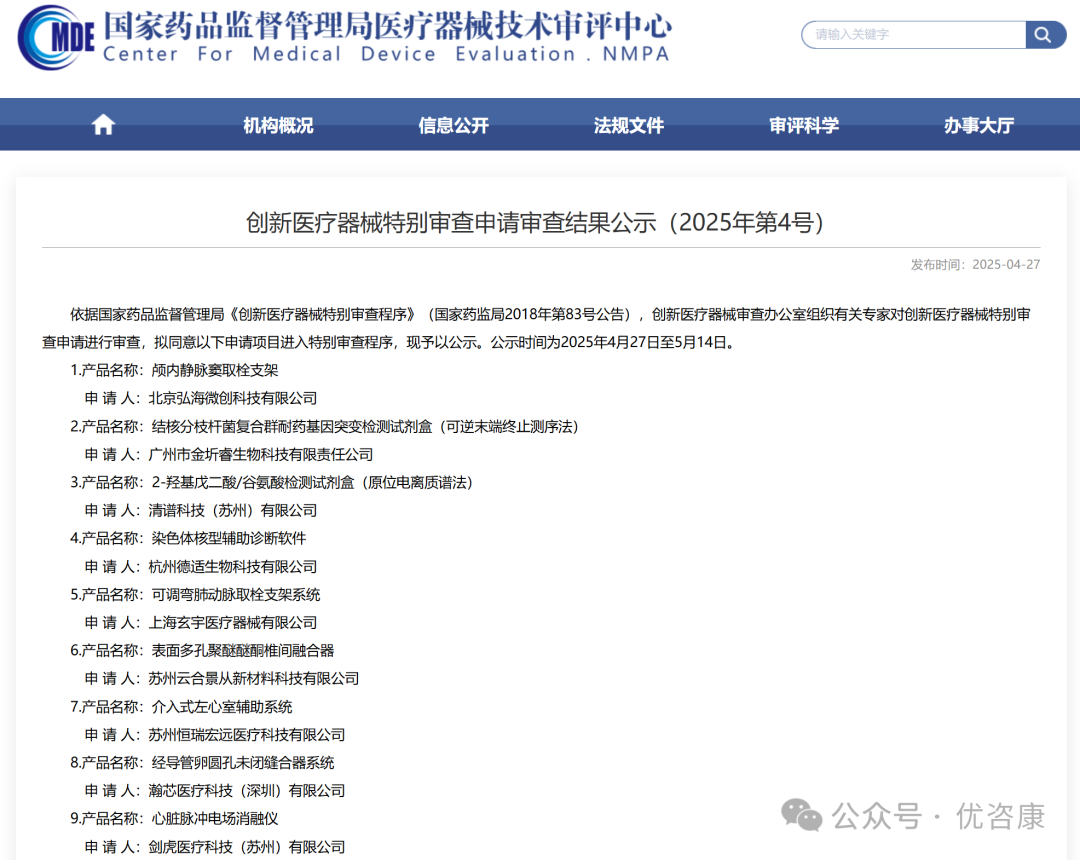 1. 哪些IVD产品可以进入创新通道 根据《体外诊断试剂注册与备案管理办法》第六十七条符合下列要求的体外诊断试剂,申请人可以申请适用创新产品注册程序: (一)申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,且申请适用创新产品注册程序的时间在专利授权公告日起5年内;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,载明产品核心技术方案具备新颖性和创造性; (二)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源; (三)产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。 2. 2025年进入国家局创新通道的IVD产品 2025年,已经有6款IVD领域的产品进入到创新通道,除了今天公示的3款,还有3款分别是:珠海圣美生物诊断技术有限公司的“人类3号和10号染色体异常细胞检测试剂盒(荧光原位杂交法)”;苏州方科生物科技有限公司的“麻风分枝杆菌核酸检测试剂盒(荧光PCR法)”;上海捷易生物科技有限公司的“新生儿TREC/KREC基因检测试剂盒(荧光PCR法)”,具体内容如下: 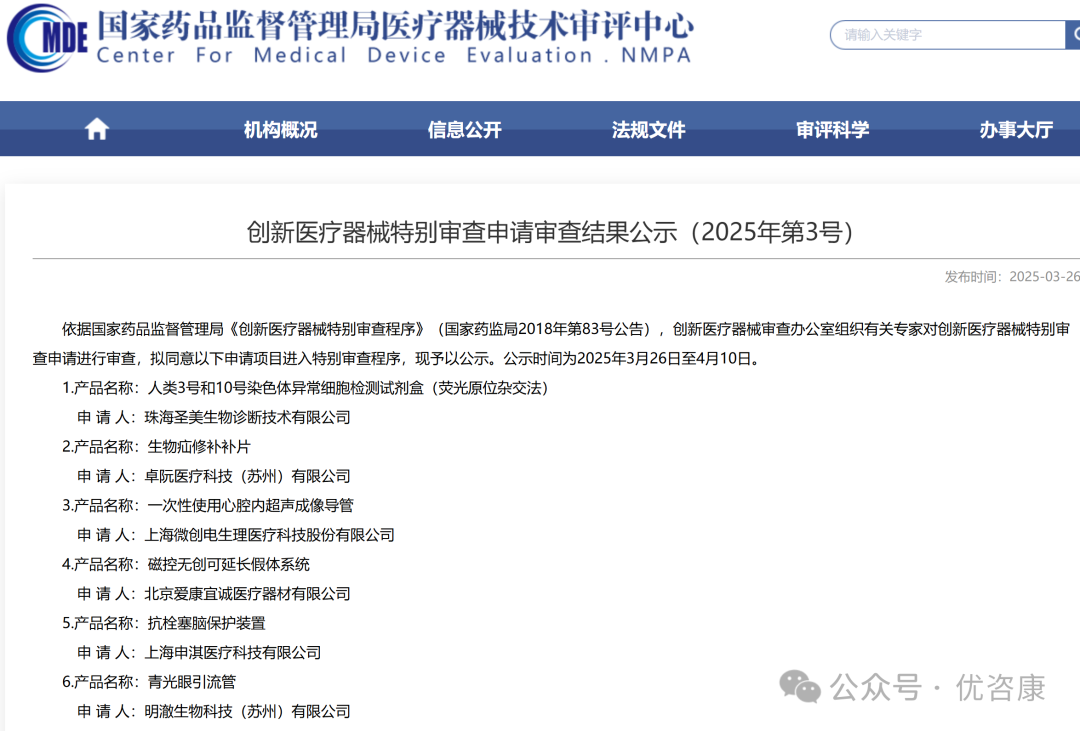  |
 /3
/3 