金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
蛋白质标准化V:赋值。国际临床化学和检验医学联合会(IFCC)科学分部2 soren blirupp - jensen1 *, A. Myron Johnson2和Marianne Larsen3(代表IFCC血浆蛋白委员会)1瑞典Lund大学医院临床化学学系2儿科和妇产科学学系临床免疫化学,Dako A/S,哥本哈根,丹麦
摘要
我们提出了一种使用参考物质对靶物质中的血清蛋白进行值分配的实用方案。本协议基于血清基质之间的直接值转移模型,旨在改善使用参考物质CRM 470(现标记为ERM-DA 470)或类似参考物质的商业校定器的值分配。
该程序描述了与值赋值有关的一般原则以及实际原则(附示例)。实际的转移方案是基于6个标准物质稀释度和6个目标物质稀释度的多次测定。转移方案要求每天多次测量,在几天内重复,一个重要的先决条件是所有的重构和稀释都是通过称重控制的,从而减少了转移的不确定性。在允许使用标准物质作为校准器和目标物质作为样品的开放系统中,现在可以通过评估单个回归图直接评估两种材料的比例(存在或不存在矩阵效应)。如果没有发现矩阵效应,回归线将以等于两种物质浓度之比的斜率穿过零。在封闭系统中,必须使用专用商用校准器;现在将标准物质和目标物质作为样品在此校准器上进行测定。因此得到了两个回归图;如果在两种材料和校准器之间不存在基质效应,则参考材料和目标材料都将显示零截距,并且两个斜率的比值将等于浓度的比值。中华临床医学杂志2008;46:1470-9。
关键词:蛋白质标准化;方案;赋值;价值转移。
缩略语:C′=标准物质中规定的分析物浓度;CR=标准物质中重构后的实际分析物浓度;Cr=目标物料中未知分析物浓度;FR(1-6)=插值得到的标准物质的相对浓度因子1-6;F1=目标物料的预稀释系数1;Fr2=目标物质的稀释系数2;Mx = x的质量(其中x可以是:重组物,水,标准物质,稀释缓冲液或目标物质);R=标准物质重构后的校正系数;T=目标材料重构后的修正系数;Y = Y的不确定度(其中Y可以是Total, Reference Material或Transfer procedure);α=线性回归线截距;β=线性回归线的斜率。
介绍
当制备国际人血清蛋白参考制剂(CRM 470)(1)时,制定了将值转移到该材料(2)的程序和方案使用参比制剂的靶物质中的蛋白质是由blrupp - jensen, Johnson和Larsen开发和出版的(3)。
认证参比物质(CRM 470,现在称为ERM-DA 470)的引入,从各个国家质量保证计划(4-7)来看,无疑改善了世界范围内定量血清蛋白测定的结果。
然而,对于某些蛋白质,不同制造商的检测结果存在高达15%的差异。有几个因素可能导致这种情况,包括(除其他外)不同的抗血清反应性、测定方法、基因决定的蛋白质本身结构变化、价值转移方法不充分以及材料之间的基质差异。在给定的情况下,这些方法中的任何一个或全部都是可操作的,并且结果可能是相加的。前三点即使不是不可能控制,也是很难控制的。
在我们的第一篇文章(3)中,我们着重于对价值传递原理的一般性讨论,并提出了必要的数学方程。然而,随着发展,我们已经意识到有必要——也受到许多用户的鼓励——为价值转移制定一个更实用(易于遵循)的协议。因此,为了帮助制造商准确地转移值,从而减少血清蛋白测定中制造商之间的偏差,鼓励作者准备一份协议,其中包含简单的数学计算和一些实用建议,以便将值从认证的参考物质转移到制造商的工作校准器(主校准器),然后转移到他们的商业校准器和控制。目前用于血清蛋白测定的方法是基于免疫化学原理,利用抗原与其相应抗体之间的特异性反应。
所有定量方法的共同之处在于校准分析的基本原则,即记录具有已知实际蛋白质浓度的校准器的不同稀释度的信号。一旦仪器被校准,未知的病人样本可以通过在建立的标准曲线上的插值进行分析和定量。
作为日常工作的一部分,临床实验室可以进行相当数量的特定定量蛋白质测定。为了做到这一点,需要可靠的分析。在过去的十年中,原始的凝胶沉淀技术已经越来越多地被快速和自动化的光学检测系统所取代,光学检测系统利用了抗原和相应抗体在液相中的快速和特异性反应。这些系统大多基于免疫比浊法和免疫比浊法,测量自由溶液中形成的抗原-抗体复合物吸收或散射的光。早期的研究(8)表明,由于抗原和抗体之间的快速反应,仪器的优化编程是获得可靠和可重复结果的一个非常重要的因素。
不同的试剂也起着重要的作用。抗抗体的特异性和滴度略有差异可能导致错误的结果。同样,反应缓冲液的组成、pH和聚合物浓度也可能影响最终结果的准确性。这导致了方法标准化的先决条件(8) 。
只要仪器编程正确,所用试剂质量足够,患者样品中的浓度将与校准器的值相关。因此,最重要的是正确地分配校准器的值。
一般原则
值转移的目的是使用国际标准制剂对目标物质中选定的蛋白质进行浓度分配。为了做到这一点,必须选择传输方法并开发传输协议。
标准物质转移方法标准物质转移协议标准物质(以前也称为标准制剂)被定义为具有已知浓度值的蛋白质制剂(例如,使用共识程序分配)。在这个值转移的示例中,使用了参考资料CRM 470(现在称为ERM-DA 470)。该材料的制备和价值分配于1993年(1)进行了记录。由于原始标准材料逐渐结束,比利时吉尔标准物质和方法研究所(IRMM)目前正在制作具有类似价值的替代材料,并应在2008年可用。
目标材料定义为具有未知浓度值的血清蛋白基质材料(例如,制造商的校准器)。
转移法应是一种完善的、公认的常规方法,如浊度法、浊度法或单径向免疫扩散法。
然而,检测条件、仪器程序或试剂的细微变化可能导致不同的结果。这导致了方法标准化的先决条件(8)。
为了最大限度地减少所有这些因素,还应使用包含详细说明、稀释方案、参数设置等的准确转移方案。
最后,需要对所得值进行数据简化和适当的统计评价。
本文概述的值转移的实用方案是试图详细描述如何进行值分配,以尽量减少值转移到制造商的血清蛋白校准和控制材料上的可变性和差异。
为了说明实际方案的各个方面,给出了一个真实的例子,详细描述了该程序的每个步骤,其中人IgG的浓度值是分配给目标材料(人血清)的值来自参考材料(ERM-470或ERM-DA470)。
直接赋值的一般程序(传输协议)
传输协议是基于在几天内重复的多次测量得到的多点值赋值。
所有用于重构和稀释的体积必须用精度为0.0001克的天平用重量控制。
标准物质:6种不同的稀释度作为校准曲线的标准,覆盖实际测量范围。
目标物料:6种不同的稀释度分布在测量范围内,作为样品放置在2个位置。
对照:1 .将特殊稀释的标准物质置于测量范围的高端,并作为样品放置在2个位置。
每天准备一组新的稀释液,并进行3次对照。
校准包括样品的测定和给予:此程序1天重复4天。
校准曲线:6种不同稀释度的标准物质用作标准品,每天重复3次,持续4天=6×3×4=72次测定。
样品:6种不同稀释度的目标物质,重复分析,每天3次,4天=6×2×3×4=144次测定。对照:1个特殊稀释标准物质,重复分析,每天3次,持续4天= 2×3×4=24次测定。
在任何经过优化和验证的免疫化学系统中均可进行值赋值。强烈建议为每个特定仪器使用适当的设置。在本文所述的例子中,使用了以下试剂和仪器:
标准物质:CRM 470 91/06 19 (IRMM,Geel, Belgium)。
目标材料:人血清蛋白校验仪x908 (DAKO A/S,哥本哈根,丹麦)。
反应缓冲液:S 2007 (DAKO A/S)。
稀释缓冲液:S 2005 (DAKO A/S)。
生理盐水溶液:0.1 M NaCI, 15 mM na -叠氮化物。
蒸馏水或非物质化水
抗体:兔抗人IgG Q 0331 (DAKO A/S)。
浊度计:Cobas Fara II (F. Hoffmann-La rocheld)。,巴塞尔,瑞士)。
天平:Sartorius, MC 410 S, Sartorius,德国。
直接赋值的实际程序
设置1天对于以下示例,选择了人类IgG真实值转移的第4天。
注册:
1。以下是特殊登记表上的文件:
a,要指定的特定血清蛋白-在本例中为人IgG。
b, 第一次运行的日期。
c,operator.
d, 仪器名称、生产厂家、型号、实验室。Instr No)。
e, 参考资料(名称、生产单位、编号, Lot. No. 以及所选蛋白质的浓度加上不确定度) ,例如,ERM-DA 470 (CRM 470) , IRMM, Lot no. 91/06 19, IgG conc 9.68 g/L,不确定度0.10 g/L。
f, 目标物料(名称,生产商,Code No, Lot, No).
g, 反应缓冲液(名称,生产厂家, Code No, Lot, No).
h。抗体(名称,生产商,Code No, Lot, No).
i,标准品稀释缓冲液(名称,生产商,Code No, Lot, No) .
j,样品稀释缓冲液(名称,生产商,Code No, Lot, No).
k,预稀释生理盐水(名称,生产厂家,Code No, Lot, No).
Pre-preparation:
2.冷冻材料在测量前一天下午在37°C下解冻。解冻后,放在天平旁过夜(室温下)。
3.冻干的材料在测量前一天的下午根据产品说明书进行重构。如果没有产品说明书,则可以使用一般建议:
A,在开始之前,将小瓶在室温下放置至少2小时。
B,轻拍小瓶在桌子的表面上,确保所有的材料已经沉淀在小瓶的底部。
C,拆卸金属密封或螺旋盖。
D,用橡胶塞称量小瓶的重量,并记录重量。
E,小心提起橡胶塞子,直到允许空气进入,并且橡胶塞子上的凹槽变得可触及为止。
F,用精密移液器加入1000 μL(或其他规定体积)蒸馏水,将橡胶塞压回原位。
G,重新称重并记录重量。
H,将药瓶在室温下放置约1h。
I,在接下来的一小时内,小心地将药瓶倒置几次(不要摇晃)。
J,把小瓶放在天平旁边过夜。
由于参比制剂(CRM 470)是冻干的,因此材料按上述方式重组。实际称重结果如表1所示。如果包装说明书上的IgG值在用1.0000 mL水重组时为9.68 g/L (C'p),则实际值(Cp)现在为:
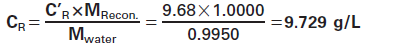
其中M是重组物的预期质量和实际质量。也可以直接使用修正系数R=MRecon/MWater,得到:Cp=C'RxR。
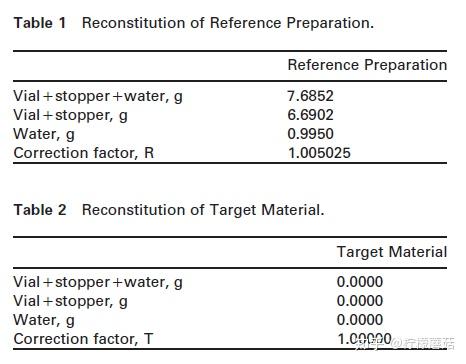
如果目标材料必须重组,则遵循类似的程序,并使用表2。然而,在这个例子中,目标材料已经是液体血清,所以不需要重组和称重。
校准标准:
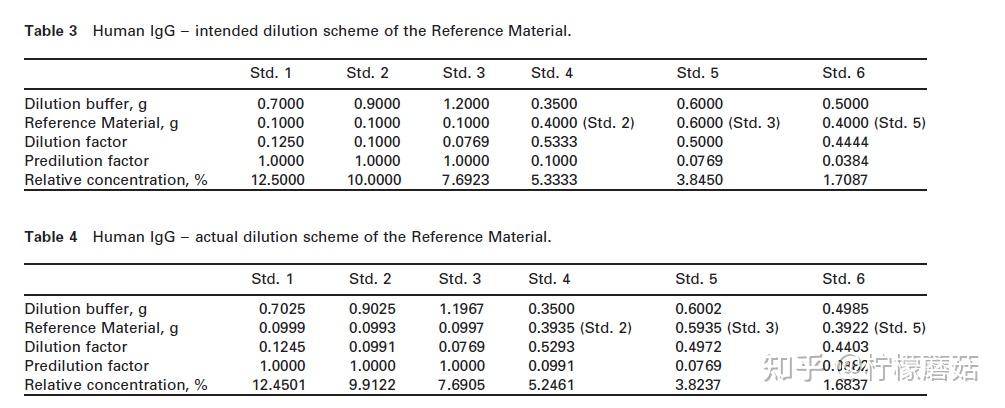
4.从重组的标准物质中制备了6种不同的稀释度。它们应作为校准曲线的标准,并应覆盖实际测量范围。如果所选蛋白质的浓度非常高,则可能需要在制作6个标准品之前对标准物质进行预稀释。IgG则不需要这样做,根据表3编制了6个标准。
表4给出了实际称重结果的一个示例。标准2和标准4的相对浓度按%计算:
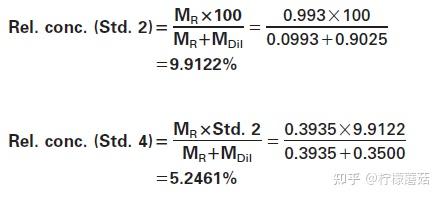
为避免移液量很小,分别从Std 2、Std 3和Std 5中制备Std 4、Std 5和Std 6。将每种不同稀释度的500 μL转移到单独的校准器杯中,并根据特定仪器的使用说明书在仪器上连续放置6个校准器位置。相对浓度软件窗口。
如所述,通过称量所有体积来手动制备所有标准品是可取的。然而,对于某些仪器,这是不可能的,因为仪器自动从单个校准器制备6个不同的标准(稀释)。
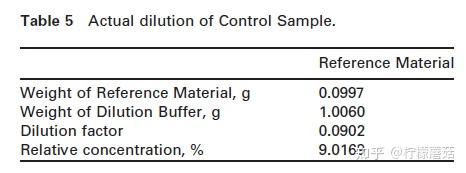
对照样品:
5,对照样品作为标准物质的特殊稀释品(表5)。它作为曲线控制,因此应使其落在校准曲线内。称重,例如0.1000 g参考血清+1.000 g稀释缓冲液和混合物。
将500 μL的对照液分别倒入两个样品杯中,放置在仪器的2个位置上。
样品制备:
6。如果目标材料被冷冻或冻干,则应按照预准备部分所述进行解冻或重组。这同样会产生校正因子(T)。
从(重组的)目标材料制备不同的稀释度。它们应作为样品,并应全部制成,使其浓度落在校准曲线内。试运行可能是建立目标材料中蛋白质的近似浓度是必要的。
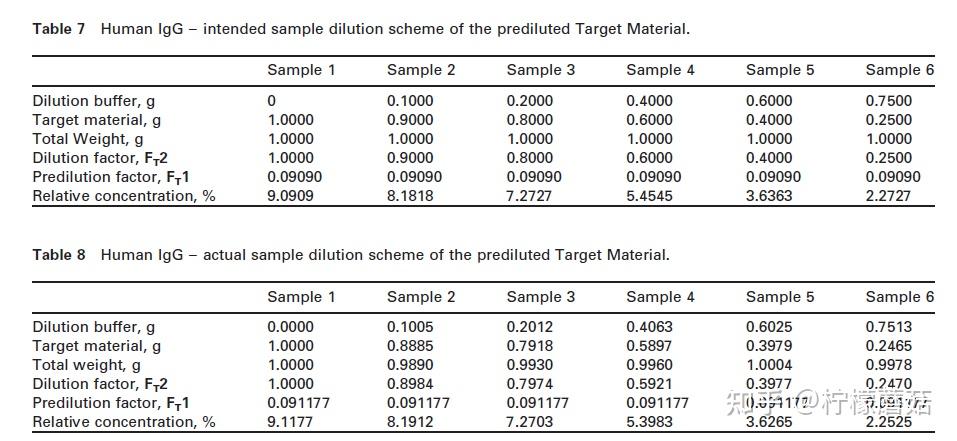
对于人IgG,建议对目标材料进行预稀释。预稀释为(1+10= 11x或0.09090):0.4000 g目标材料+4.000 g稀释缓冲液。实际预稀释液如表6所示。
根据表7,从预稀释液中制备不同的6个稀释液。
表8给出了6个样品的实际称重结果示例。样品3的稀释系数Fr2计算为:
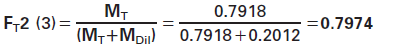
计算样品3的相对浓度%为:
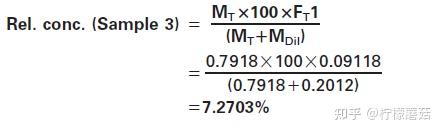
目标物质的相对浓度(%)可用于验证稀释度落在校准曲线的测量范围内(由参考物质制备)。然而,为了进一步计算,使用稀释因子Fr2(1-6)作为x值,表示样品(从目标材料制备)中IgG的确切浓度。将每种不同稀释度的500 μL分别转移到两个样品杯中,作为12个连续阳性仪器的样品放置在仪器上(2×6)。
测量
7.试剂和缓冲液装载到仪器上。特定蛋白质的最佳测定方法(见参考文献)。3、8)。
8,仪器启动,进行3次完整运行(样品和对照品的校准和测定)。这相当于值赋值过程中的1天。打印如下数据:参数设置和每次校准:校准数据,样品和控制数据和校准曲线图。
9.测量平均值以%表示标准物质的负浓度因子FR(1-6)]。为了使1天的y值具有可比性(表9)。由于这些值是通过在校准曲线上自动插值得到的,因此将这些值表示为与x值的关联,因此进行如下计算(例如,对于样本1):

实际使用的数据分别见表9、表6和表2,控制值的计算方法如下

实际数据分别来自表9和表5。
10. 校准,稀释和测量1天的样品现在已经完成结果如表10所示:
a.样本wFT2(1-6)x表示的x值计算出的相对浓度通过稀释得到的值目标材料分为6个样品和
b. wFR(1-6)x代表的样本的y值测得的相对浓度由信号插值得到的值对6个样本进行校正曲线。
11. 的控制样本作为曲线控制校准曲线预计为1.000和发现是1.0164,这很好,说明实验装置起作用了令人满意。
12. 如果参考材料和目标材料显示出真正的比例,一条直线,如果y值绘制为x值。因为x值是计算出来的基于称重(4位小数)与之相比,不确定性可以忽略不计内插值的不确定度免疫化学法测定(比浊法)。因此,建议进行最小二乘线性回归分析,
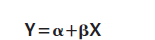
如表11所示,的截距为零回归肯定在置信区间内,允许进行新的计算,其中回归线被强制过零(图1,表12)。
13. 根据(3)斜率等于的比值两种材料中IgG的浓度;
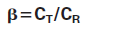
因为斜率是由直线计算出来的回归分析,未知浓度CT
原文地址:https://zhuanlan.zhihu.com/p/1906749895064425801 |
|
 /3
/3 