金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
酶化学
一、 酶的基本概念和作用特点
1.酶
是生物活细胞产生的、以蛋白质为主要成分的生物催化剂。某些 RNA 具有催化活性,称为核酶(ribozyme)。
2.酶催化剂的特性:
极高的催化效率;高度的专一性;
催化活性易受外界条件影响;
催化活性在细胞内受严格调控;
某些酶催化活性与辅助因子有关;
酶的蛋白质本质。
二、酶的国际分类和命名
1.命名
每一种酶应有一个系统名称和一个习惯名称。
2.国际系统命名法原则
规定每种酶的名称应当标明酶的底物及催化反应的性质。如果一种酶催化两种底物起反应,应在他们的系统名称中包括两种底物的名称,并以“:”将其隔开。
3.分类编号方案
每个酶的分类编号由字母“EC”加上四个数字组成,数字间用“.” 分开。按酶促反应性质将酶分为 6 大类。分类编号中的第一个数字表明一个酶属于六大类中的哪一类。第二个数字是该酶的亚类,指明底物中被作用的基团或键。第三个数字是该酶的亚-亚类。第四个数字是该酶在亚-亚类中的排序。
三、酶的作用机制
1.酶的活性中心
酶分子中与底物结合并起催化作用的空间
(1)活性中心包括两个功能位点
结合位点:保证底物正确结合在酶的催化位点附近,决定了酶的专一性。
催化位点:负责底物键的断裂及新键的形成,决定了酶的催化能力。在含有辅因子的酶中,辅因子或其上的某些基团也参与酶活性中心的组成。
(2)酶活性中心的特点
A只占酶分子结构中很小部分(1-2%);
B具有特定的三维结构,酶和底物结合的专一性取决于活性中心中原子的精致排列;
C并不是和底物的形状正好互补,具有柔性;
D以弱键与底物结合;
E位于酶分子的一个凹穴中,形成疏水区。
2.酶的专一性和高效性机制
(1)酶的专一性
指一种酶只能催化某一种或某一类物质发生特定的反应。分为结构专一性和立体异构专一性两类。
(2)高效性机制
邻近和定向效应;
底物形变;
共价催化;
酸碱催化;
疏水微环境的影响;
金属离子催化。
四、影响酶促反应速度的主要因素
1.底物浓度、酶浓度、温度和 pH 值、激活剂与抑制剂都对酶促反应速度产生影响。
米氏方程表示了底物浓度与反应速度之间的关系。 米氏常数 KM 的物理意义:当酶促反应速度达到最大反应速度一半时的底物浓度,单位为摩尔。
2.抑制剂
抑制作用分为可逆和不可逆抑制作用两种。
可逆抑制作用有分为:
竞争性抑制作用;
非竞争性抑制作用;
反竞争性抑制作用。
(1)可逆抑制作用
抑制剂与酶蛋白以非共价键结合,结合是可逆的;可通过透析法除去抑制剂,恢复酶的活性。
(2)竞争性抑制作用
抑制剂和底物竞争酶的结合部位,可通过增加底物浓度减轻或消除抑制作用。
(3)非竞争性抑制作用
酶可以同时与底物和抑制剂结合,两者间无竞争作用,这类抑制作用不能通过提高底物浓度来解除。
(4)反竞争性抑制作用
抑制剂不能与游离的酶结合,必须在酶和底物结合后,才能与ES 结合形成 ESI 复合物;ESI 复合物不能分解为产物;这类抑制作用较为少见。
(5)可逆抑制作用的动力学
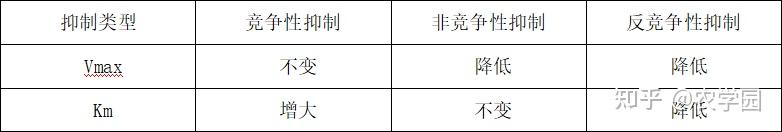
五、别构酶和共价修饰酶
1.别构效应与别构酶
酶分子的非催化部位与某些化合物可逆地非共价结合后发生构象的改变,进而改变酶活性状态,称为酶的别构调节或别构效应。具有别构调节作用的酶称为别构酶。
2.共价修饰酶
这类酶经其他酶对其结构进行共价修饰,使其在活性形式与非活性形式间相互转变。
六、同工酶
催化相同的化学反应,但酶蛋白的分子结构及化学组成不同的一组酶。
七、维生素和辅酶
维生素是生物生长发育和代谢所必需的微量小分子有机化合物。维生素有脂溶性和水溶性两种。主要掌握各种水溶性维生素作为何种辅酶的前体,相应的酶催化哪种反应。
八、酶的分离纯化
分离纯化的方法与分离纯化蛋白质相同。为防止酶变性失活,纯化过程通常在低温下进行。
纯化过程中需要进行酶活力的测定。酶活力以酶催化的反应速度或酶活力单位来表示。酶活力测定是酶的定量测定;测定酶活力就是测定酶促反应速度;研究酶反应速度以反应初速度为准。
 |
|
 /3
/3 