金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
写在前面的话:
蹉跎良久,总算周末又开始更新了。最近跑到细胞质量行业作为一个微生物人不得不对快速微生物检查进行研究,毕竟这是刚需,而且其有那么多优点。接下来个人会现将法规进行梳理,然后在分享个人使用某家快速无菌检查设备的心得还有个人进行方法适用性的一些考量。
快速微生物检查的优点(图片来源于网络,仅供学习交流用,感谢Charles river老师的图片)
正文
1.快速微生物检查的相关法规
- 美国药典-USP<1071>RAPID MICROBIAL TESTS FOR RELEASE OF STERILE SHORT-LIFE PRODUCTS A RISK-BASED APPROACH(无菌短货架期产品放行的快速微生物检查法: 依据风险评估的方法)
- 美国药典-USP<1223>VALIDATION OF ALTERNATIVE MICROBIOLOGICAL METHODS(微生物替代方法验证)
- PDA TR33(中英文)-2013 可选择的和快速的微生物检测方法的评价验证与执行
- 美国药典-USP [71] STERILITY TESTS无菌检查
- 中国药典—1101无菌检查法
- 中国药典—9201药品微生物检验替代方法验证指导原则
- 欧洲药典EP.2.6.27 Microbiological Examination of Cell-based preparations (9.2)
- CAR-T 细胞治疗产品质量控制检测研究及非临床研究考虑要点
- 细胞类制品微生物检查法草案拟公示稿
以上便是个人搜索的就有参考价值的快速微生物检查法规,其中美国药典<1071>关于各快速微生物检查方法的比较很有参考价值,PDA TR33关于等效性的描述较为有参考价值。对于只在国内申报的细胞产品可以参考《CAR-T 细胞治疗产品质量控制检测研究及非临床研究考虑要点》和《细胞类制品微生物检查法草案拟公示稿》来制定自己的快速无菌检查策略,前者适合确定那些物料或中间产品要做控制,后者对如何取样和如何进行方法适用性及检验进行了较明确的论述。吐槽一点:后者里面的建议菌株找了好多人家我都没买到,国内某些机构真不给力。
2.各国药典对快速微生物替代方法验证的细节
2.1中国药典-9201药品微生物检验替代方法验证指导原则
随着微生物学的迅速发展,制药领域不断引入了一些新的微生物检验技术,大体可分为三类:1)基于微生物生长信息的检验技术,如生物发光技术、电化学技术、比浊法等;2)直接测定被测介质中活微生物的检验技术……;3)基于微生物细胞所含有特定组分成分的分析技术……。这些方法与传统检查方法比较,或简便快速,或具有实时或近实时监控的潜力,使生产早期采取纠正措施及监控和指导优良生产成为可能,同时新技术的使用也促进了生产成本降低及检验水平的提高。
………………………………………….
在开展替代方法对样品检验的适用性验证前,有必要对替代方法有一个全面的了解。首先,所选用的替代方法应具备必要的方法适用性证据,表明在不含样品的情况下,替代方法在不同类型的微生物检验中所具有的专属性、精密度和检测限等参数。这些证据或由替代方法的研发者提供,或由方法使用者完成。使用者在基本确认替代方法的适用性后,应采用样品按表1规定的参数逐一进行验证,以确认替代方法可否用于该样品的检验。验证至少使用2 个批号的样品,每批样品应平行进行至少 3 次独立实验。
对替代方法有一个全面的了解和需要替代方法研发者提供一些研究数据这一点,目前只能是找到一些参考论文,厂家提供的验证数据有限(推脱说他们做了给我们我们还要自己做),而且存在一个Bug就是论文作者的实验细节并不是公开的,数据的可借鉴价值有限。此时选择哪家的仪器设备只能看他们合作方是谁有哪些成功案例了。
除此以外还有一点值得商榷,就是不含样品的情况下替代方法的方法适用性和含样品的替代验证。按现有药典的意思是需要加样品进行方法验证,然而近年有发布了《细胞类制品微生物检查法草案拟公示稿》提到了方法适用性。方法验证里面实际上包含了方法适用性的内容,那么起草新的征求意见稿似乎没有任何意义。再就是替代方法验证对比两个方法是否等效,是否可以不加样品进行比对,然后进行方法适用性确认样品是否存在抑制,将替代方法验证和方法适用性分开来看,特别是基于培养的方法。其次对于细胞治疗产品真的没有那么多细胞和培养上清供实验者使用。所以个人以为发布《细胞类制品微生物检查法草案拟公示稿》有可能有此类考虑,只进行方法适用性试验,样品的问题就好解决一些。
然而目前没有明确的法规支持,只能另寻出路。在公司存在多种细胞制剂产品时,只进行某一细胞产品的替代方法验证,然后其他的走评估路线,而其他产品或其相关中间产品只做方法适用性是目前较为稳妥的解决方法。
2.2USP <1223> Validation of Alternative Microbiological Methods 美国药典通则《1223》替代微生物方法验证
The U.S. Pharmacopeia (USP) has long provided mechanisms for the implementation of alternative assay methods or procedures to analyze compendial articles. General Notices, 6.30 Alternative and Harmonized Methods and Procedures states, “Alternative methods and/or procedures may be used if they provide advantages in terms of accuracy, sensitivity, precision, selectivity, or adaptability to automation or computerized data reduction, or in other special circumstances.” This statement allows considerable user latitude in the decision to use an alternative procedure for routine product release, provided that proper technical and scientific attention is paid to the selection, qualification, and implementation of the method. If a product has proven safe in widespread use when released or controlled using current methods, the implementation of an alternative method which can be well-correlated to the existing method should be straightforward.
美国药典长久以来都为替代检测方法与流程的应用提供了相应机制。凡例6.30替代与协调方法和流程中提到,“在准确性、灵敏度、精确度、专属性、自动化适用性或电子数据管理等方面存在优势的情况下,或其他特殊情况下,可以使用替代方法或流程。”这一表述为用户在选用替代方法进行常规产品放行上提供了相当的灵活性。如果某一产品在现有的放行或监控方法下已有广泛的安全使用历史,那么与现有方法有良好可比性的替代方法也应该易于实施。
美国药典替代方法验证里面提到了,基于药品安全的角度使用替代方法,并不是替代方法可比即可使用,还需要积累一定的历史数据。
《CAR-T 细胞治疗产品质量控制检测研究及非临床研究考虑要点》中也有类似于美国药典的规定,只是表述存在差异:“在可行的情况下,首选药典方法用于无菌检查,但考虑到CAR-T 细胞产品的特殊性,也鼓励研究者开发快速的无菌检查法作为中间过程监测或放行检测方法,且在临床试验过程中须按照中国药典要求以及其它国际要求对快速无菌法进行充分验证,且在早期使用时,快速方法应与药典方法平行进行,在获得充分的比对数据后,结合无菌生产全过程的风险评估设计放行策略,才有可能替代药典方法”。
基于以上规定积累一定的历史数据势在必行,而且我们需要尽早进行快速方法与药典方法的平行检查,在获得充分的对比数据后在考虑替代。
2.3EP 5.1.6 Alternative Methods for Control of Microbiological Quality 欧洲药典 5.1.6 微生物质量控制的替代方法
欧洲药典的规定和中美药典规定大致相同,不同之处个人以为主要是以下内容:
Alternative methods for the control of microbiological quality have shown potential for real-time or near real-time results with the possibility of earlier corrective action. These new methods, if validated and adapted for routine use, can also offer significant improvements in the quality of testing。
欧洲药典特别强调了快速微生物检查方法可以实时快速进行检查,从而可以在出现异常时及时采取纠正措施。这一点让我想到一个问题,就是快速微生物检查方法是真的快吗?进行方法适用性时我们会发现,实际上快速微生物检查并没有快很多。快速微生物检查方法可以实时监测能尽早发现异常也许才是其快的含义。其次这也让我明确一件事,我们不需要证明快速微生物检查方法快,只需要证明其与药典方法可比即可。至于培养周期是基于大量研究数据给出的结果,我们就佛性的拿来就用了。
2.43)USP <1071> Rapid microbial tests for release of sterile short-life products: A risk-based approach 《美国药典》<1071> 无菌短货架期产品放行的快速微生物检查法:依据风险评估的方法
美国药典<1071>除去其对各种快速微生物检查方法进行深入讲解外,其中文中的四个表格对我们进行风险评估有很高的参考价值。其中表2对各方法的检测限、获得结果的时间和取样量范围进行了总结,我们在制定选择自己的快速微生物检查方法时可以用作参考。表1、表3和表4可作为风险评估参考。

表1 给药途径的典型剂量和相关风险等级(图片来源于网络仅供学习交流用)
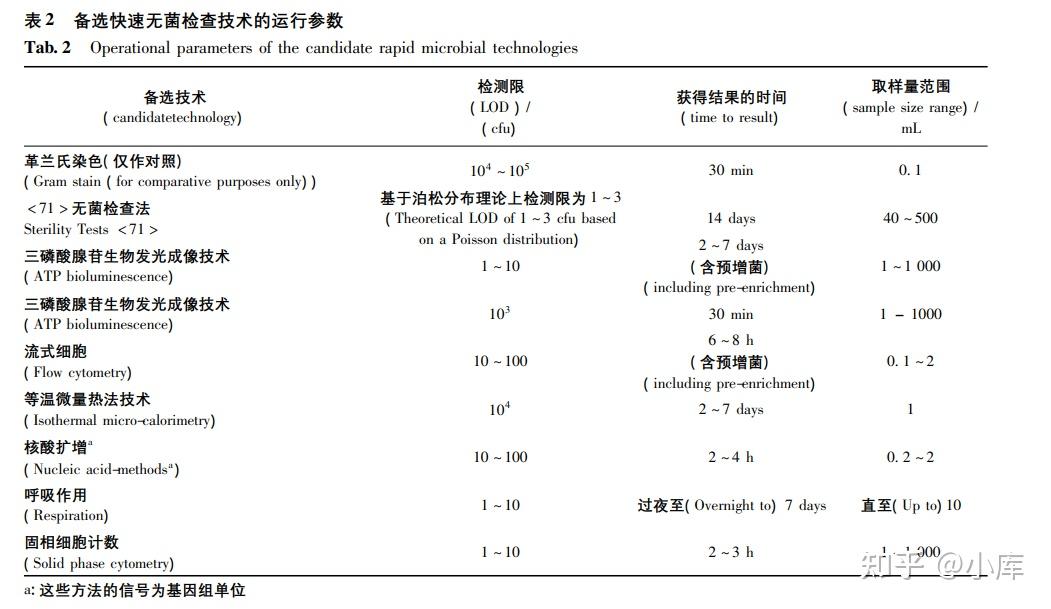
表2 备选快速无菌检查技术的运行参数(图片来源于网络仅供学习交流用)
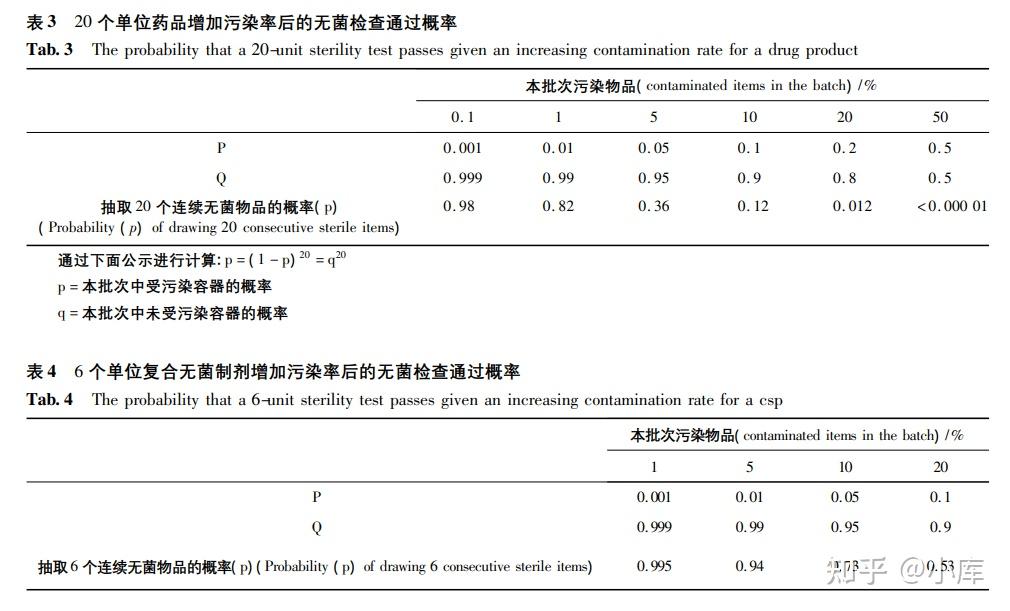
无菌检查通过概率表(图片来源于网络仅供学习交流用)
美国药典<1071>的其他细节内容建议读者自行看药检所老师的翻译文稿:刘洪祥,李娅男,白海娇,曹晓云. 《美国药典》(42/NF37) 无菌短货架期产品放行的快速微生物检查法:依据风险评估的方法. 中国药品标准,2020,21(3)(可在智库资源里搜索,个人已上传)。
3.PDA TR33(中英文)-2013 可选择的和快速的微生物检测方法的评价验证与执行
PDA TR33除对替代方法验证具体要求进行了规定,还给出了方法验证和方法适用性的定义相对更为客观。证明方法是否等同是方法见的对比测试。适用性测试才是实际产品是否适用的实验。

PDA TR33截图(图片来源于网络,仅供参考学习用)
4.小结
梳理完法规多少对快速微生物检查有了一定的了解,我的结论就是药典方法短期内还不能扔,我们需要积累数据来证明方法可替代,而不是简单的做一次替代方法验证就可以了。其次过程控制和终产品放行是两回事,过程控制使用快速微生物检查替代传统药典方法是可以的,而终产品放行还要使用药典方法。对于某些货架期只有几小时的细胞治疗产品只能基于风险进行放行,不在正常放行之列。
微生物检查项目都是安全性检查项目,安全无小事。建议各位要进行快速微生物检查的小伙伴尽早积累数据,以便尽早获批。
以上便是个人学习快速微生物检查的心得,供参考。接下来分享BD快检仪器的使用心得。
【博普智库】10W+份专享资源随心下✅ 1000+节精品课程在线学✅
学习链接;博普智库 - 制药人专业知识分享平台
公众号:博普智库 添加微信可获取您的岗位学习资料包 BPYD2021
原文地址:https://zhuanlan.zhihu.com/p/554780148 |
|
 /3
/3 