金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
在组织病理学中,免疫组化是广泛使用的诊断和检测方法,过去几十年里,这种基于抗体的技术在FFPE的样本上取得进一步的发展,被认为是癌症诊断的金标准工具,为各种肿瘤的免疫治疗提供有价值的信息。然而这项技术存在一些无法逾越的瓶颈,如主观因素造成的不同判别差异,定量的不精确性和检测靶标数量有限等,这些局限性导致对复杂的肿瘤微环境中无法进行更深层次的研究。
基于这样的考虑,多重免疫组化/免疫荧光(multiplex immunohistochemistry/immunofluorescence, mIHC/IF)技术在免疫治疗领域得到越来越多的关注,因为它可以在单个组织切片中同时检测多种生物标志物,在细胞成分、细胞功能和细胞间相互作用中获得更为丰富的空间表达谱数据,高效且可重复。
本文是International Journal of Molecular Sciences上题为“Multiplex Immunoflfluorescence: A Powerful Tool in Cancer Immunotherapy”的文章,文章介绍了多种免疫检测技术,基于不同的原理,可主要分为染料去除技术、荧光团灭活技术、信号放大技术、DNA barcode技术、质谱流式细胞技术,这些方法对临床治疗、转化医学、精准医学中不同生物标志物的表达具有一定的诊断准确性。
No.01
基于染料去除的技术平台

作为mfIHC常用的方法之一,染料去除技术发展的平台被用于研究肿瘤组织样本,技术的基本原理是清除样品中的标记,用一种新的不同的标记对样品进行染色,并重复该过程,在单个样品中检测多种抗原。
1.1 Sequential immuno-peroxidase labelling and erasing (SIMPLE)
对于多靶标的检测,最常用的方法是多色免疫荧光,但受到可用荧光标签的可行性组合数量的限制、通道串色、抗体交叉反应性和石蜡包埋组织的自发荧光的影响,为了克服这些问题,开发了SIMPLE的新方法。
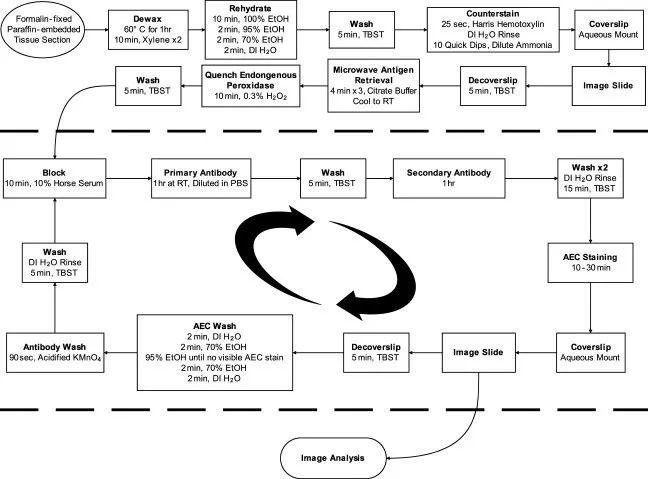
技术点:AEC(3-氨基-9-乙基咔唑)底物显色+酸性高锰酸钾洗脱抗体
SIMPLE方法的流程与免疫组化相似,在检测前期进行脱蜡、水化和苏木素复染,成像获得仅复染的图像,进行苏木素复染的原因是使用苏木素染色的图像作为背景层,制作多色合成图像,后期用软件进行合成;成像后进行抗原修复,同时去除了复染,随后进行一抗二抗的孵育和AEC染色(AEC是过氧化物酶 (Peroxidase) 的生色底物,在过氧化物酶的催化下,过氧化氢氧化AEC形成稳定的红色沉淀产物,该红色产物不溶于水,但溶于有机溶剂),每轮染色后对组织进行成像,然后在乙醇中剥离AEC沉淀物,用酸性高锰酸钾洗脱抗体,进入下一轮染色成像。AEC沉淀颜色可以选择伪颜色更换,最终多个伪彩色图层叠加生成最终的合成图像。
优点:灵敏性高,特异性好,分析相同的细胞或组织特征以表征多种抗原;
缺点:AEC试剂有毒,图像叠加操作繁琐,因组织在乙醇中反复剥离沉淀,多轮孵育后图像质量降低;
1.2 Iterative bleaching extends multiplexity (IBEX)
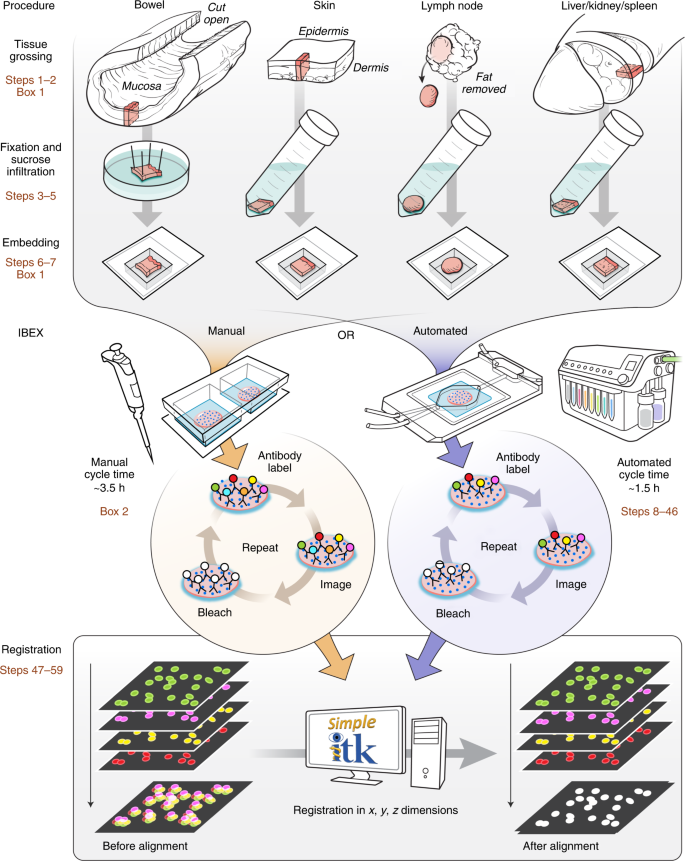
IBEX是一种迭代免疫标记和化学漂白方法,与免疫组化流程相似,不同是通过LiBH4灭活荧光基团;
技术点:LiBH4敏感染料+LiBH4抗性染料
LiBH4消除荧光信号:Alexa Fluor (AF)488、AF532、藻红蛋白 (PE)、AF555、eFluor (eF)570、iFluor (iF)594、AF647、eF660、AF680、AF700 和 AF750
LiBH4抗性染料:Hoechst,JOJO-1,AF594和eF615
优点:可以由具有基本实验室技能的老师以相对较低的成本实施,较短的免疫标记和漂白时间;
缺点:仅限于专用仪器和专有试剂,并且对于基于质谱(MS)的方法,可能需要训练有素的工程人员提供仪器支持。
No.02
基于荧光基团的技术平台

这个技术平台与染料去除技术平台大致相似,但它不是通过PH或者光漂白去除荧光基团,而是通过化学灭活的方式。
2.1 Multiplexed flfluorescence microscopy method (MxIF)
多重荧光显微镜法 (MxIF)的成像平台可以用于任何组织,它保留了常规分析中细胞分散时丢失的组织空间结构,为深入研究肿瘤微环境、开发生物标志物及发现肿瘤异质性等方面提供了强有力的工具。
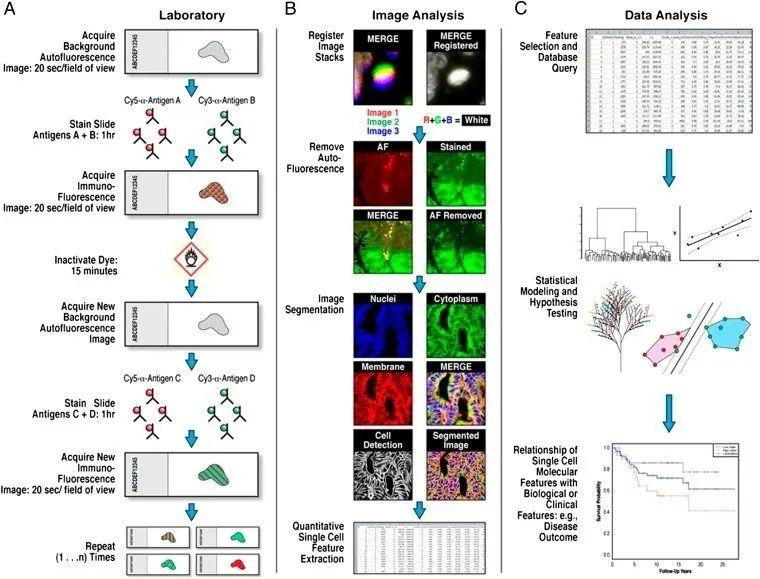
技术点:获取背景自身荧光组织图像后,用基于花青素的荧光标记抗体对样品进行染色,然后用碱性氧化化学法对荧光染料进行失活。
(A)图,先在应用荧光染料偶联的一抗之前获取背景自发荧光(AF)组织图像,采集染色图像,随后进行染料灭活并用新的直接偶联抗体重新染色,获取新图像,并重复循环,直到所有靶抗原耗尽;
(B)记录染色图像,从每个染色图像中去除背景AF,并将图像分割成上皮和基质区域,然后鉴定单个细胞和相应的质膜,细胞质和核区域,随后进行数据分析。
优点:可将60种直接标记的抗体应用于单个组织切片;
缺点:耗时且仪器较昂贵。
2.2 Cyclic immunofluorescence (CycIF)
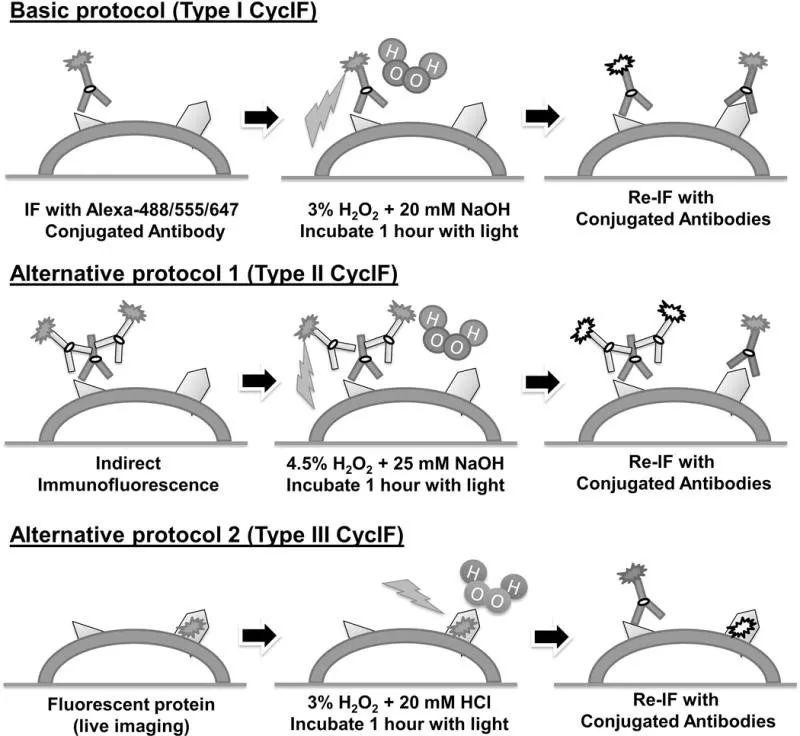
该技术有三种不同的方法:
方法一:固定、透化、封闭、一抗、Hoechst染色、成像、荧光基团灭活、进入下一个Cycle周期
通过直接与Alexa Fluor染料偶联的抗体染色并以四种颜色成像,在过氧化氢和光存在下使用温和碱灭活荧光团,然后进行另一轮染色和成像,是最普遍有用的方法;
方法二:固定、透化、封闭、一抗、二抗、Hoechst染色、成像、荧光基团灭活、进入下一个Cycle周期
涉及二抗的间接免疫荧光,在直接标记的抗体不可用或信号较弱的情况下有用,但一般首选方法一,因为间接免疫荧光的多重性受到二抗的同种型和物种反应性的限制,除非采用蛋白酶介导的抗体剥离,否则每个实验只能使用一种原种/同种;
方法三:固定、透化、封闭、一抗、Hoechst染色、成像、灭活荧光蛋白(仅在第一个CycIF循环之前执行)、 Alexa 染料的荧光基团灭活、进入下一个Cycle周期
适用于多重免疫荧光与表达荧光报告蛋白的细胞的活细胞分析相结合。
优点:简单通用,不需要昂贵仪器和试剂,适用于高通量测定和筛选应用;
缺点:耗时长操作繁琐。
2.3 Chip Cytometry微环境多靶标蛋白分析系统
Chipcytometry 微环境多靶标蛋白分析系统是一种高质量的多重生物标志物成像分析技术,整合了创造性的样品存储技术、多重多通道检测技术和基于图像的单细胞分析方法,从根本上突破了传统方法的各类局限,可以清晰地可视化样本中的生物标记物的表达和空间分布并获得深入的定量数据。
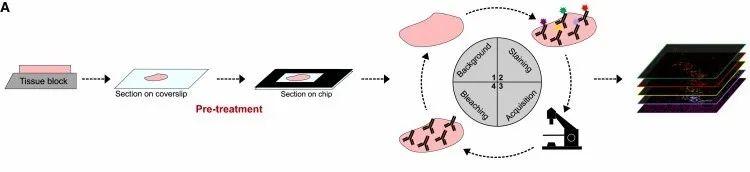
过程:将FFPE切片固定在微流控芯片表面,记录背景自身荧光,随后,用多达五种荧光团结合的一抗对组织切片进行染色,获得图像,最后对荧光团进行漂白,进入下一个染色周期。
优点:具有不同亮度的图像堆栈的形式采集,允许在低信号和高信号强度之间获得更好的分辨率,及可以去除组织本身带来的自体荧光的影响;
缺点:因为容易脱片,因此修复条件需要温和;数据处理繁复,需要通过叠加拼接将带有单个标记的层添加到表示每个颜色通道中像素强度总和的复合图像中。
应用领域:在细胞与组织水平,可以应用于临床前和临床生物标志物开发、免疫细胞分型和免疫监控、肿瘤等复杂组织微环境描绘等;
在分子与机理研究水平,进行细胞表型分析、细胞内 DNA/RNA 分析等。
No.03
基于信号放大的技术平台

为了克服检测低丰度靶标的局限性,研究学者发展出信号放大技术,包括修饰的半抗原、酰胺信号放大(TSA)和纳米晶体量子点,这里主要着重介绍TSA技术。
3.1 Nanocrystal Quantum Dots(QDs)
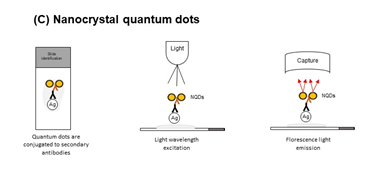
纳米晶体量子点(QDs)使用特殊涂层的纳米晶体(直径约1-10nm),称为量子点,而不是显色剂,纳米晶量子点具有被任何类型或波长的光激发以发射非常薄的荧光光谱的特性,这些荧光标记物与多光谱成像技术相结合,用作与不同抗体标记结合的荧光探针进行多重检测。
优点:纳米晶体量子点具有良好的光学特性,可以避免与组织切片相关的内源性自身荧光,具有高的光稳定性;
缺点:具有适当化学性质的纳米晶体数量有限。
3.2 Tyramide Signal Amplification (TSA)
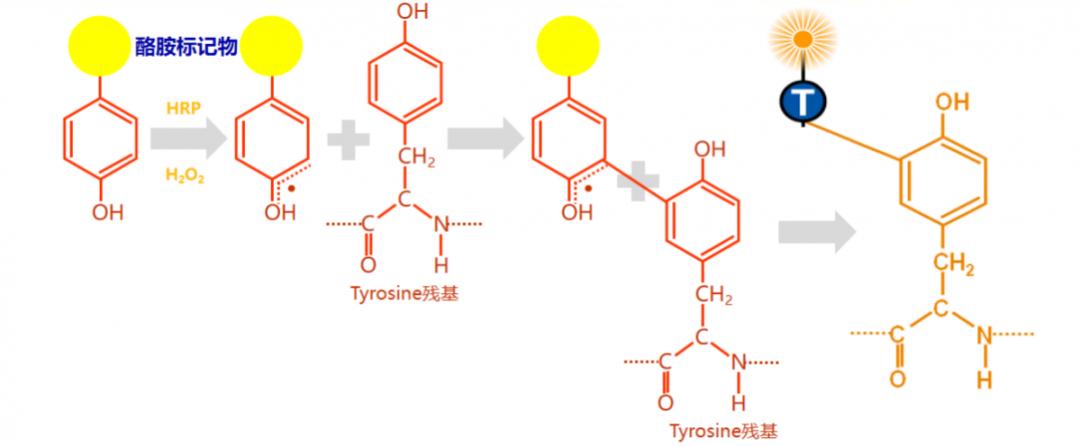
原理:利用酪胺Tyramide的过氧化物酶反应(酪胺盐在HRP和H202催化下形成共价键结合位点),产生大量的酶促产物,该产物能与周围的蛋白残基(包括色氨酸、组氨酸和酪氨酸残基)结合,这样在抗原-抗体结合部位就有大量的生物素沉积。
优点:1.一抗种属没有限制
2.可在一张玻片上检测多个靶标,节约样本和抗体
3.荧光信号不容易淬灭
4.可结合HAlO分析软件,得到大量数据,如细胞/蛋白间相互作用关系,浸润空间分析;
缺点:对于非特异性信号无法去除,随信号增强而升高。
No.04
基于DNA barcode的技术平台

为了收集有限样本中超多指标的生物学信息,研究学者开发了一种基于DNA barcode的技术,DNA barcode是指生物体内能够代表该物种的、标准的、有足够变异的、易扩增且相对较短的DNA片段,基于这种特性对抗体进行加工,从而实现多重检测的目的。
4.1 Codetection by indexing (CODEX)
原理:超多标(CODEX)技术结合了寡核苷酸标记(Barcode)和微流控自动染色技术,其核心设计原理是每种抗体上标记特异性寡核苷酸“条码标签”(Barcode),成像所需的荧光染料(report)是通过和Barcode互补序列特异性结合,使得该技术突破可见光谱荧光成像通道数量的限制。
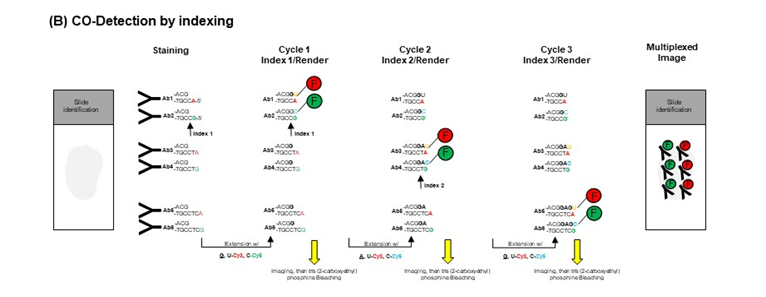
连接顺序:抗原—一抗—report,多轮孵育,多轮成像,每轮孵育完3个后成像,洗脱再进行下一轮;
每轮孵育3个为了保证相邻的荧光通道不会串色,小于3个效率低,大于三个容易串色。
优点:1.可实现50+靶标检测
2.所有一抗可同时孵育
3.可以在任何三色荧光显微镜上进行,从而将常规荧光显微镜转换为多维组织渲染和细胞术的工具
缺点:1.一抗效价高,特定的仪器,不适合商用
2.无二抗或TSA,敏感性低,低丰度靶标不易识别
3.适用于石蜡、冰切和细胞涂片样本,但不适用于细胞爬片。
4.2 Digital Spatial Profifiling (DSP)
数字空间分析DSP是针对肿瘤免疫和肿瘤微环境高精度、多维度分析的新一代空间组学技术,可以在单张切片上通过形态学指导选择兴趣点(Region of Interest,ROI),来实现基于每个兴趣点微环境的多达90种蛋白或>1,8000重癌症转录组的原位表达谱分析,其定量效果、通量和可靠性远超传统的以荧光信号为基础的多重免疫组化与多重免疫荧光技术。可以将DSP空间组学技术与单细胞测序技术结合,深入阐明免疫调节策略和治疗方案的选择。
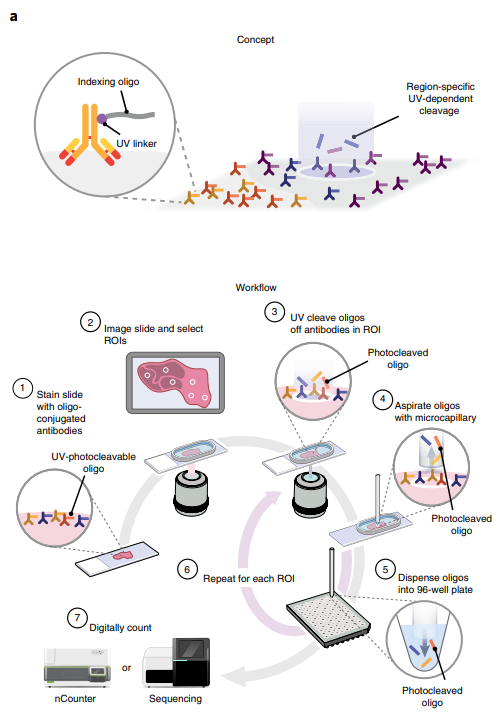
基本流程:1.寡核苷酸通过紫外线光裂解接头共价偶联一抗或mRNA杂交探针进行原位捕获;
2.通过形态学指导进行ROI(兴趣区)划分后,对ROI进行紫外光解并收集兴趣点区域靶标上的寡核苷酸序列;
3.解离的寡核苷酸再通过杂交法经由nCounter计数或采用建库方法实现与二代测序的接头,从而对蛋白质或RNA进行高通量检测。
优点:1.样本兼容性强:适用于FFRE和新鲜冷冻组织等多种样本;
2.多组学研究:可在空间指定区域定理分析RNA、也可定量分析蛋白质;
3.多靶标检测:可以额外定制多达60个定制靶标,如非编码RNA,病毒RNA等
4.下游流程直接对接Illumina二代测序技术进行定量分析
缺点:在将DNA寡核苷酸转移到多孔板分析前,最多使用4中荧光团标记的抗体选择ROI且不能生成图像。
No.05
基于质谱流式细胞的技术平台

过去,流式细胞术是研究单细胞水平的重要方法,但是流式细胞术中同时检测的荧光团数量是有限,因此发展出了质谱流式细胞技术(Mass Cytometry MC),它是一种将流式细胞技术与质谱分析技术结合在一起的新技术,这种融合技术能在单细胞水平上同时分析超过40种细胞参数,极大的增加了流式细胞分析评估复杂细胞系统和过程的能力。
5.1 Imaging mass cytometry (IMC)
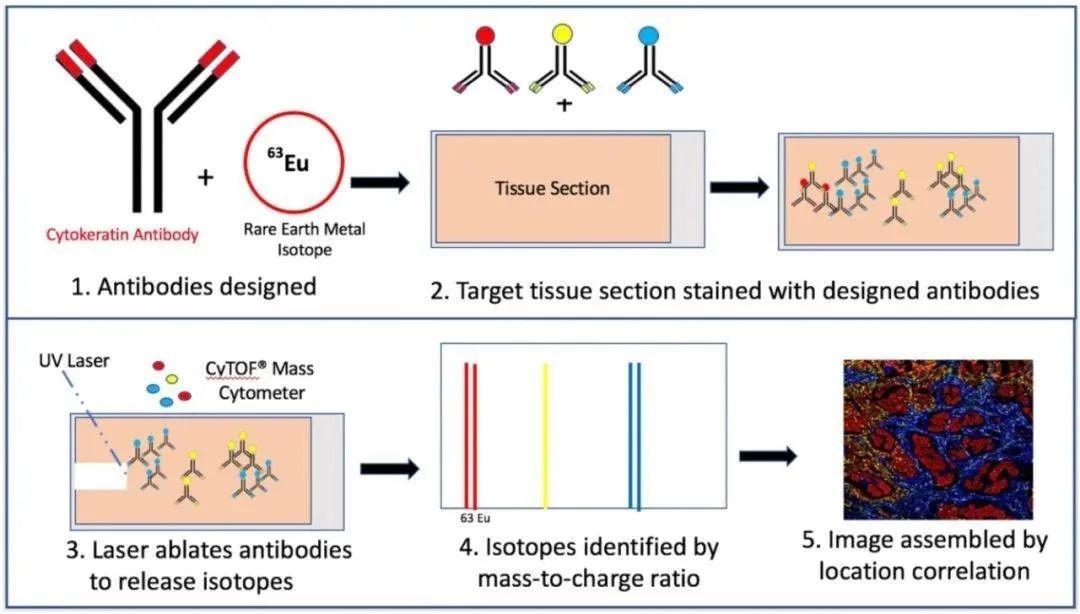
原理:机器每次会用激光在组织切片上消融一小块区域,如果每次激光消融的区域越小,也就能得到组织切片中更加细致的蛋白表达数据;之后会在腔室中充入惰性气体,这类气体会带着这些等离子体进入质谱流式仪,通过检测同位素的含量,就可以推测在这一片区域中,被标记的蛋白或核酸的含量;当整片组织被扫描完之后,我们可以获得每一个点的信息,并以此为依据重建整个组织的图像。
优点:1.能在组织或细胞水平上同时对40多种的蛋白标志物进行成像;
2.通道间无干扰,无需计算补偿,ICP质谱具有超高的分辨能力,可以完全区分开用来标记的各种元素,这样不仅使实验流程得到简化,也节约了标本和试剂;
3.金属标签数量多,并具有极低的自发荧光背景,用来作为标签的金属元素在细胞中的含量极低,而金属标签与细胞组分的非特异性结合能力极低,所以信号的背景极低;
局限性:虽然通过质谱流式细胞技术可以同时分析许多的细胞过程,但质谱流式的同位素大多数来自镧系元素,再加上一些非镧系元素大概有40多种,可以标记的抗体不能超过这些同位素的数量,所以每次实验前需要标记哪些抗体需要谨慎选择。
5.2 Multiplexed Ion Beam Imaging (MIBI)
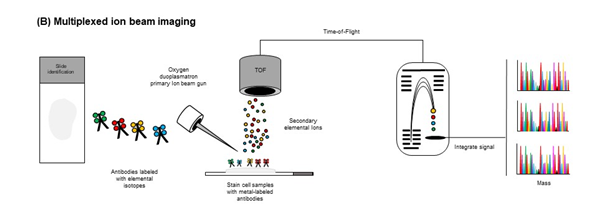
原理:与IMC相似,但使用二级离子质谱法对标记有同位素金属报告的抗体进行成像,样品与一抗结合稳定镧系元素孵育,该稳定镧系元素高度富集于单个同位素,这些制备的样品具有栅格化氧双浆体初级离子束的特征,提供结合抗体的游离镧系化合物作为次级离子,最后,利用二次离子束成像(SIMS)对金属偶联抗体进行定量分析。
优点:可在亚细胞分辨率下同时检测40+标记物,从而实现单细胞分割和细胞类型分类,以及对TME中存在的细胞进行空间分析;
缺点:仪器极其昂贵且需要大量培训。
No.06
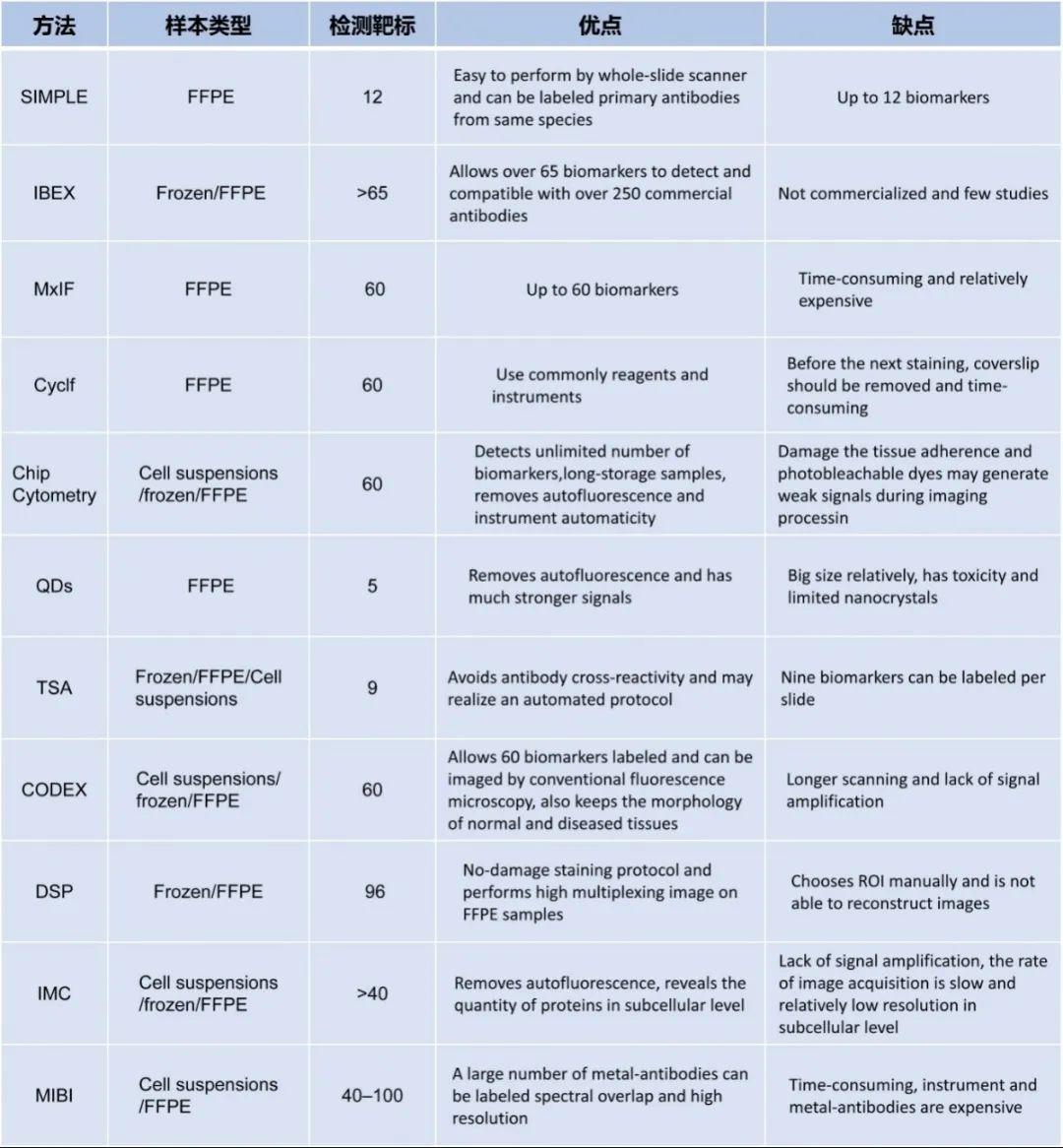
不同方法的汇总与比较
与传统的荧光方法相比,mfIHC具有显著的优势,可以同时检测多个靶标,与放疗、化疗和手术等癌症治疗方法相比,免疫治疗可以更方便观察到病变组织微环境中的变化,选择合适的免疫检测手段能从根本上寻找许多癌症的治疗方向和预后恢复程度。
参考文献
1.Glass, G., Papin, J. A., & Mandell, J. W. (2009). SIMPLE: a sequential immunoperoxidase labeling and erasing method. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society, 57(10), 899–905. https://doi.org/10.1369/jhc.2009.953612
2.Radtke, A.J., Chu, C.J., Yaniv, Z. et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc 17, 378–401 (2022). https://doi.org/10.1038/s41596-021-00644-9
3.Gerdes, M.J.; Sevinsky, C.J.; Sood, A.; Adak, S.; Bello, M.O.; Bordwell, A.; Can, A.; Corwin, A.; Dinn, S.; Filkins, R.J.; et al. Highly multiplexed single-cell analysis of formalin-fifixed, paraffifin-embedded cancer tissue. Proc. Natl. Acad. Sci. USA 2013, 110, 11982–11987.
4.Lin JR, Fallahi-Sichani M, Chen JY, Sorger PK. Cyclic Immunofluorescence (CycIF), A Highly Multiplexed Method for Single-cell Imaging. Curr Protoc Chem Biol. 2016 Dec 7;8(4):251-264. doi: 10.1002/cpch.14. PMID: 27925668; PMCID: PMC5233430.
5.Jarosch, S.; Kohlen, J.; Sarker, R.S.J.; Steiger, K.; Janssen, K.P.; Christians, A.; Hennig, C.; Holler, E.; D’Ippolito, E.; Busch, D.H. Multiplexed imaging and automated signal quantifification in formalin-fifixed paraffifin-embedded tissues by ChipCytometry. Cell Rep. Methods 2021, 1, 100104
6.Levin, M.; Flor, A.C.; Snyder, H.; Kron, S.J.; Schwartz, D. UltraPlex Hapten-Based Multiplexed Fluorescent Immunohistochemistry. Methods Mol. Biol. 2021, 2350, 267–287.
7.Bobrow, M.N.; Shaughnessy, K.J.; Litt, G.J. Catalyzed reporter deposition, a novel method of signal amplifification. II. Application to membrane immunoassays. J. Immunol. Methods 1991, 137, 103–112.
8.Mahvi, D.A.; Liu, R.; Grinstaff, M.W.; Colson, Y.L.; Raut, C.P. Local Cancer Recurrence: The Realities, Challenges, and Opportunities for New Therapies. CA Cancer J. Clin. 2018, 68, 488–505.
9.Goltsev, Y.; Samusik, N.; Kennedy-Darling, J.; Bhate, S.; Hale, M.; Vazquez, G.; Black, S.; Nolan, G.P. Deep Profifiling of Mouse Splenic Architecture with CODEX Multiplexed Imaging. Cell 2018, 174, 968–981 e915.
10.Merritt, C.R., Ong, G.T., Church, S.E. et al. Multiplex digital spatial profiling of proteins and RNA in fixed tissue. Nat Biotechnol 38, 586–599 (2020). https://doi.org/10.1038/s41587-020-0472-9
11.Singhal, S.K.; Byun, J.S.; Park, S.; Yan, T.; Yancey, R.; Caban, A.; Hernandez, S.G.; Hewitt, S.M.; Boisvert, H.; Hennek, S.; et al. Kaiso (ZBTB33) subcellular partitioning functionally links LC3A/B, the tumor microenvironment, and breast cancer survival. Commun. Biol. 2021, 4, 150.
12.Angelo, M.; Bendall, S.C.; Finck, R.; Hale, M.B.; Hitzman, C.; Borowsky, A.D.; Levenson, R.M.; Lowe, J.B.; Liu, S.D.; Zhao, S.; et al. Multiplexed ion beam imaging of human breast tumors. Nat. Med. 2014, 20, 436–442.
原文地址:https://zhuanlan.zhihu.com/p/647443268 |
|
 /3
/3 