金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
“分子胶水”的发现
“分子胶水”,顾名思义,它就像一种粘合剂,通过特异性指引两种或多种大分子结合在一起,进而产生特定的生物学效应。人们对于这种分子的认知,经历了一个较为漫长的过程。
1881年,生物学家的达尔文和他的儿子弗兰西斯首先利用金丝雀翳(yi)草的胚芽鞘进行植物向光性实验。研究发现植物胚芽鞘尖端产生的某种物质,在单侧光照射条件下会影响植物胚芽鞘、根和茎的生长方向。1942年,植物学家Kenneth V. Thimann成功分离并鉴定出该物质是一种吲哚乙酸,可以促进植物生长,故取名为“生物素”。之后的研究证明生长素是一种关键的植物激素,能调控植物生长和发育的许多方面,但是生物素如何调控基因的表达仍是未知之谜。
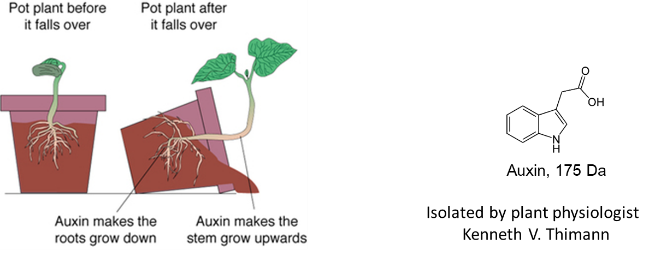
▲生物素的发现(来源:American Journal of Botany, 1942, 29, 598)
直到2007年,第一个被鉴定为“分子胶水”的小分子——生物素的作用机制才被完全揭示[1]。通过研究拟南芥TIR1-ASK1复合物的晶体结构,研究人员发现生物素可以填充进蛋白界面的一个疏水室,像胶水一样与植物中的TIR1(Transport Inhibitor Response 1, 转运抑制应答因子1, 泛素连接酶SCFTIR1的亚结构域) 结合,同时它也会结合底物蛋白Aux/IAA(一种转录抑制子),进而调控TIR1-Aux/IAA复合体的形成。通常情况下,底物蛋白Aux/IAA在被修饰前会与TIR1解离,但TIR1和生长素结合后形成了一个完整的表面结构,使底物蛋白Aux/IAA与TIR1的结合更加紧密,难以解离,进而发生泛素化,最终被蛋白酶体降解。
泛素化与PROTAC技术的诞生
1976年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose在研究红细胞裂解物的过程中发现,有一种多肽可以启动蛋白降解过程,后来证明这个多肽就是泛素(Ubiquitin,Ub)。而他们也因揭示了泛素调节的蛋白质降解过程荣获2004年的诺贝尔化学奖。

▲2004年获得诺贝尔化学奖的三位科学家(来源:The Nobel Foundation)
基于这个重大发现,有学者提出:是否可以利用泛素介导蛋白降解机制,人为降解一些蛋白?
2001年,受“分子胶水”和泛素化的启发,融合了靶蛋白识别和介导蛋白降解的PROTAC(PROteolysis TArgeting Chimera)技术应运而生。美国两院院士Deshaies和Crews博士等人首次提出了PROTAC概念,并成功地设计和合成了第一批PROTAC小分子用于降解甲硫氨酰氨肽酶2(MetAP-2)。
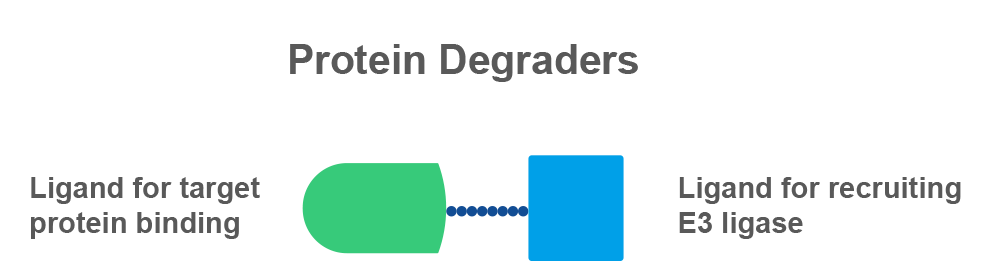
▲PROTAC分子结构
PROTAC小分子一端是结合靶蛋白的配体,另一端是结合泛素连接酶E3的配体,二者通过链接子相连。PROTAC分子进入细胞后,靶蛋白的配体端负责结合靶蛋白(Protein of Interest, POI),E3的配体端负责结合泛素连接酶E3,形成POI-PROTAC-E3连接酶的三元复合物。通过耦联泛素-蛋白酶体途径(Ubiquitin-proteasome pathway, UPP),介导靶蛋白POI被贴上泛素“标签”,而带有多个泛素“标签”的POI会被蛋白酶体识别并降解,使靶蛋白的浓度被选择性地降低。
DEL技术与PROTAC分子的构建
PROTAC分子的构建体系,包括靶蛋白的筛选、靶蛋白的制备和连接子的选择等,同时兼顾靶蛋白-双功能小分子-E3连接酶的三元复合体的形成。
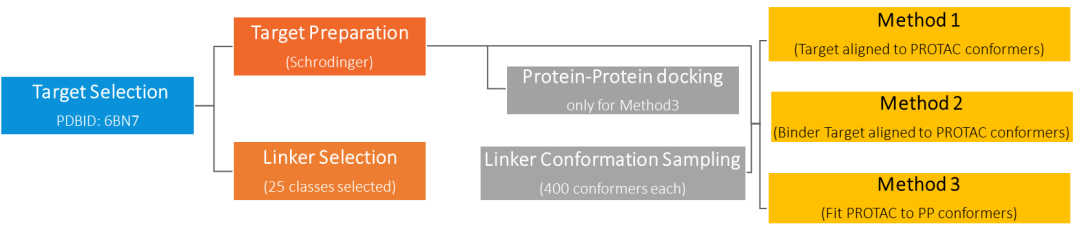
▲PROTAC分子构建的工作流程
DNA编码化合物库(DNA Encoded Library, DEL)是一种用来筛选苗头化合物的新技术。DEL分子一端是小分子化合物,另一端是对应的DNA标签,中间是一段连接子。通过二代测序技术,我们可以方便地读取DNA标签信息,进而推断出小分子化合物信息。每个“分子积木”都有一段专属的DNA标签对其进行标记,在DEL分子完成化学反应连上“分子积木”时,其对应的DNA标签即可通过酶连反应进行添加,确保识别的唯一性。
同时,“分子积木”的排列组合与DNA标签的排列组合一一对应,确保每一个新合成的小分子化合物都具有唯一的DNA标签。DEL库的合成基于“Split and Pool”的方法,通过不同“分子积木”间的排列组合,可以快速地合成海量的小分子化合物。DEL库中的化合物容量超过百亿个,覆盖了绝大多数成药化合物的化学空间。通过解码亲和筛选后获得的DNA序列,就能快速找到与靶蛋白结合的小分子。
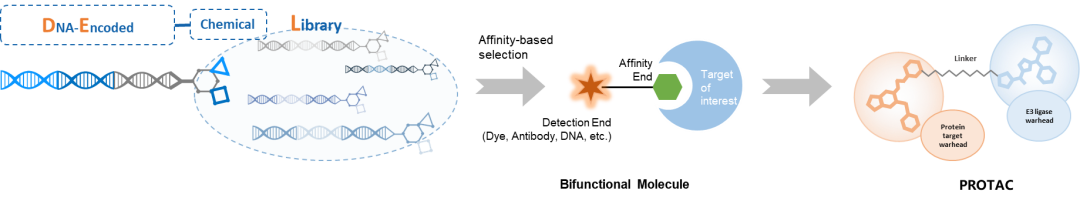
▲DEL分子与PROTAC分子
PROTAC分子作为一种特殊的双功能小分子,它的结构设计与DEL分子高度一致。由于DEL分子中也包含了一个连接子,因此可以提示构建PROTAC分子时连接子的最佳位置,如果基于现有的DEL分子来设计 PROTAC分子,药物研发速度和效率将得到了极大的提升。
与基于功能的高内涵筛选(High Content Screening, HCS)和高通量筛选技术(High Throughput Screening, HTS)不同, DEL筛选技术打破了以往一对一的筛选模式,在以下几个方面的做到了创新:
>> 基于亲和性筛选,确保靶蛋白和配体间存在物理结合
>> 海量化合物容量的DEL库,实现了小分子结构的多样性和创新性
>> 筛选所需蛋白耗量少,周期短和多靶点/条件平行筛选
靶向性PROTAC分子构建完成后,还需要通过一系列的生物物理学、生物化学等综合性检测,才有机会进入临床实验阶段。全流程归纳如下:
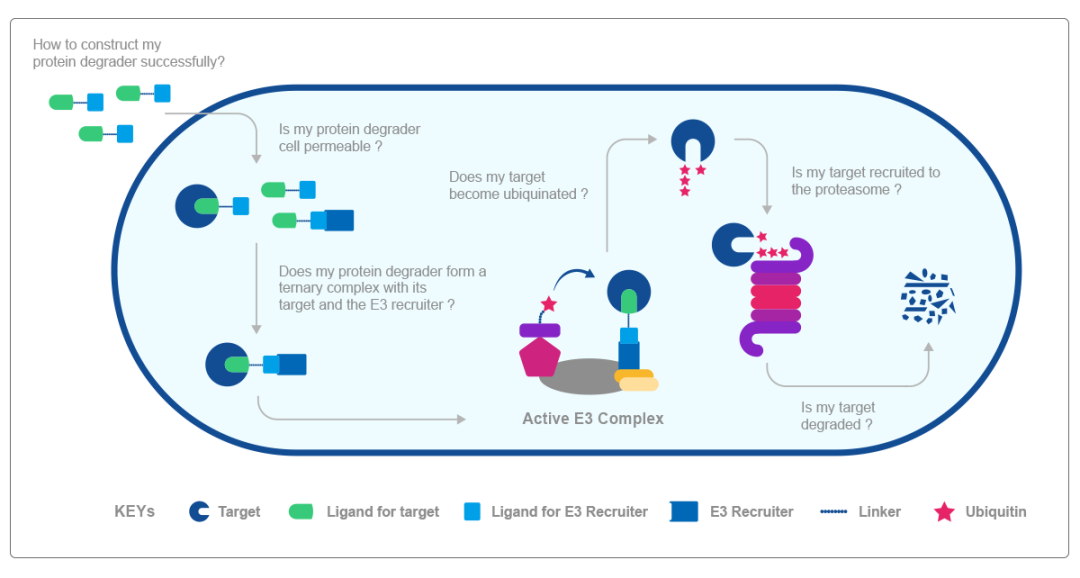
▲PROTAC分子介导靶蛋白降解工作流程图
第一步:如何成功构建PROTAC分子;
第二步:PROTAC分子能否成功穿透并进入细胞;
第三步:一旦进入细胞,靶蛋白-PROTAC分子-E3连接酶的三元复合物能否形成;
第四步:能否形成活化的E3复合体;
第五步:靶蛋白能否被泛素化;
第六步:泛素化的靶蛋白能否被蛋白酶体识别并结合;
第七步:靶蛋白是否发生降解。
经过20年的探索和发展,PROTAC技术现在已经在药物研发领域初露锋芒。借助先进的生物物理学和结构生物学方法,科学家可以针对以往难以成药的靶点,自主构建PROTAC分子。通过使用“分子胶水”或更为复杂的分子结构,突破传统小分子药物的局限性,精准调控一些重要的生物学过程,如转录、信号级联反应、蛋白质折叠和降解等,进而发挥作用, 争取实现“指哪打哪”的战略目标。
结语
有成千上万种致病的蛋白,传统小分子药物仅能针对位于细胞表面的一小部分发挥作用。而绝大多数致病蛋白都位于细胞内或核内,且表面相对平滑,生物大分子和小分子药物皆无能为力。
而泛素化参与调控细胞周期、增殖、凋亡、分化等大量生命活动,在蛋白质的降解等过程中起重要作用,与肿瘤、心血管、自身免疫等疾病的发病密切相关。PROTAC技术利用人体泛素—蛋白酶体降解系统,打破了药物设计的传统观念。大量临床前和临床研究表明,PROTAC小分子药可采用口服在内的多种给药途径,给药后在人体组织器官中分布广泛。由于PROTAC分子降解靶蛋白的作用机制类似催化剂,除了具有用量小,利用率高等优势,还能避免靶蛋白突变产生的耐药性。
通过技术的革新,PROTAC技术重新定义了小分子药物,为新药研发开拓了新的方向。
参考资料:
1.Tan, X., Calderon-Villalobos, L., Sharon, M. et al. Mechanism of auxin perception by the TIR1 ubiquitin ligase. Nature 446, 640–645 (2007).
2.Asatsuma-Okumura, T.; Ito, T.; Handa, H. Molecular Mechanisms of the Teratogenic Effects of Thalidomide. Pharmaceuticals 13, 95(2020).
⤵️喜欢我们的内容,欢迎关注@药明康德市场部!或者点赞、评论、分享给其他读者吧! |
|
 /3
/3 