7月29日— 国内血糖监测龙头企业三诺生物传感股份有限公司(300298.SZ)今日公告,其主动撤回了自主研发的第一代持续葡萄糖监测系统(CGM)在美国食品药品监督管理局(FDA)的注册申请。此消息引发市场强烈反应,公司股价今日开盘大幅下挫,盘中一度跌近9%。  关键事件:主动撤回FDA申请 产品信息:撤回申请的产品为“TRUE VIE Continuous Glucose Monitoring System (I3)”,属于510(k)注册路径,适用于2岁及以上人群糖尿病管理,旨在替代指尖采血并可与自动胰岛素剂量系统通信。 申请历程:该申请于2024年12月通过FDA受理审核(Acceptance Review),进入实质性审查阶段(Substantive Review)。 撤回原因:公司称,基于FDA的发补要求、市场变化以及其全球CGM管线产品的上市策略,经审慎研究后决定主动撤回。 后续计划:公司表示将根据FDA反馈完善相关试验研究,未来择机提交“新产品”的上市注册申请。公告强调此次撤回是公司主动决策,不会影响其全球化商业目标和持续研发,亦不会对当期经营产生重大影响。 市场反应:股价遭遇重挫 尽管公司声称影响有限,资本市场反应却相当剧烈: 股价暴跌:29日上午开盘,三诺生物股价21.05元,大跌8.32%(-1.91元)。 交易活跃:成交量显著放大至12.12万手,成交额达2.56亿元,换手率2.68%。 可转债下跌:公司可转债“三诺转债”(123090)亦下跌1.17%,报118.358元,溢价率高达93.76%。 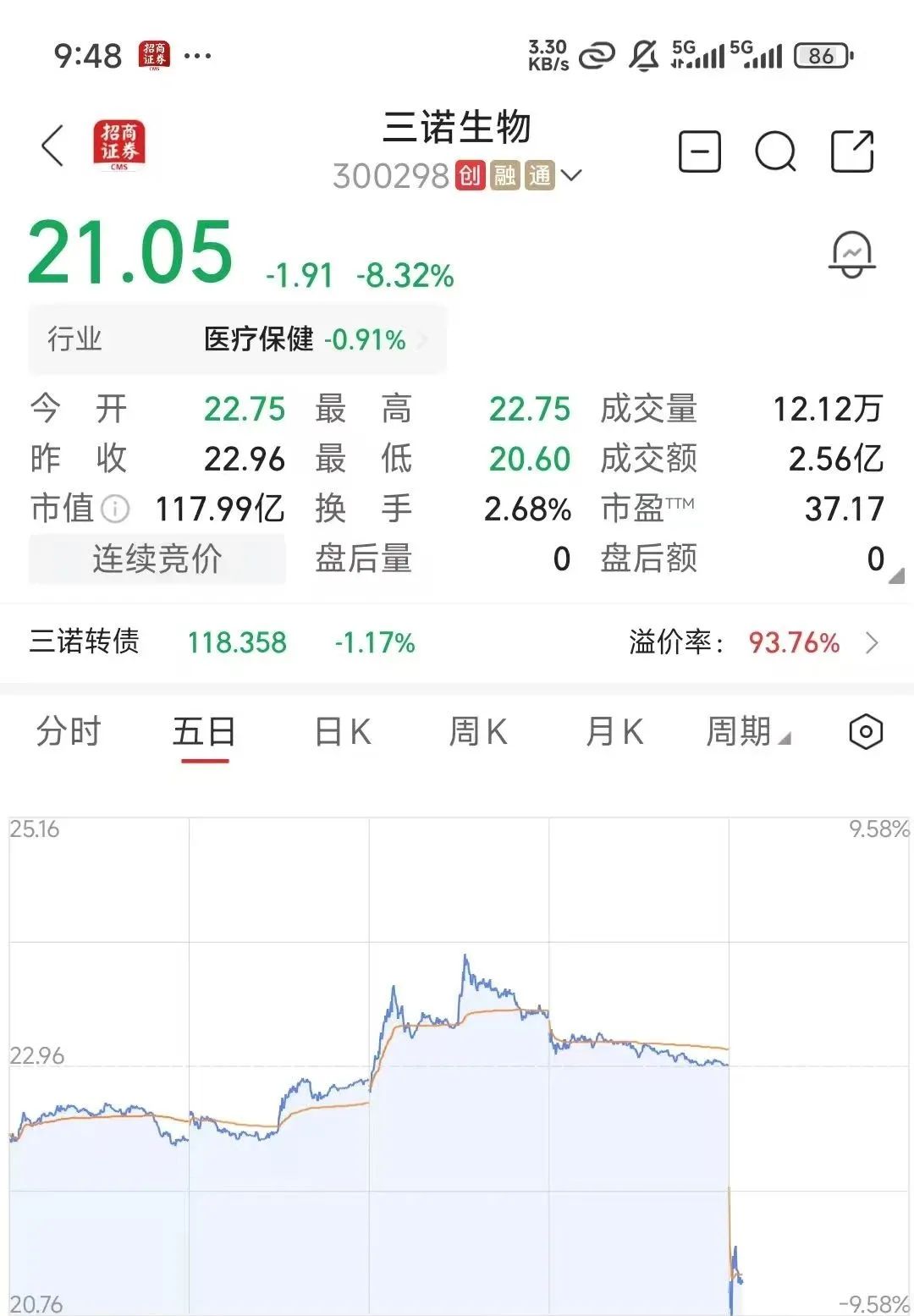 公司表态与风险提示 不影响现有业务:三诺生物在公告中重申,此次撤回不会对公司现有产品销售产生影响,也不会对未来生产经营与业绩产生重大影响。 研发不确定性:公司同时提示,CGM产品的研发及全球上市受政策法规、技术要求、审评标准等多重因素影响,存在不确定性,提醒投资者注意投资风险。 分析与展望 此次撤回第一代CGM产品的FDA申请,标志着三诺生物进军美国CGM市场的进程遭遇波折。公司提及“全球CGM管线产品上市策略”及未来将提交“新产品”申请,暗示其CGM技术路线或策略可能正在进行调整优化。FDA对CGM产品的性能、准确性和安全性要求极其严格,此次撤回反映了公司在满足国际最高监管标准过程中面临的挑战。市场的大幅下跌则体现了投资者对于其国际化进程受阻以及CGM产品商业化时间表可能延后的担忧。未来,公司如何根据FDA反馈完善产品,以及何时、以何种“新产品”再次冲击美国市场,将成为关注焦点。 |
 /3
/3 